Een enkel eiwit scannen met de precisie van één aminozuur
Met behulp van nanopore DNA sequencing technologie zijn onderzoekers van de TU Delft en de University of Illinois erin geslaagd één enkel eiwit te scannen: door een gelineariseerd eiwit langzaam door een minuscuul nanogaatje te trekken, één aminozuur tegelijk, konden de onderzoekers elektrische stroompjes aflezen die betrekking hebben op de informatieinhoud van het eiwit. De onderzoekers publiceerden hun proof-of-concept vandaag in het vakblad Science. Deze nieuwe, single-molecule peptide scanner betekent een doorbraak in de identificatie van eiwitten, en opent de weg naar single-molecule eiwit sequencing en het in kaart brengen van de eiwitten in een enkele cel.
Eiwitten zijn de werkpaarden van onze cellen, maar toch weten we nog niet welke eiwitten we allemaal bij ons dragen. Een eiwit is een lange peptideketting van 20 verschillende soorten aminozuren, vergelijkbaar met een halsketting met verschillende soorten kralen. Aan de hand van de DNA-blauwdruk kunnen we voorspellen uit welke aminozuren een eiwit bestaat. Het uiteindelijke eiwit kan echter sterk afwijken van de blauwdruk, omdat een eiwit nog allerlei veranderingen ondergaat nadat het gemaakt is. De huidige methoden om eiwitten te meten zijn duur, beperkt tot grote volumes, en ze kunnen veel zeldzame eiwitten niet detecteren. Met nanopore technologie is men in staat gebleken om afzonderlijke DNA-moleculen te scannen en te sequencen. Een team onder leiding van Cees Dekker (TU Delft) heeft deze techniek nu aangepast om in plaats daarvan een enkel eiwit te scannen, met de precisie van één aminozuur.
"In de afgelopen 30 jaar is nanopore DNA sequencing ontwikkeld van een academisch idee tot een echt werkend apparaat," legt Cees Dekker uit. "Dit heeft zelfs geleid tot commerciële draagbare nanopore sequencers die de gigantische miljardenmarkt voor genetische toepassingen bedienen. In ons werk breiden we dit nanopore concept nu uit naar het lezen van afzonderlijke eiwitten. Dit kan grote impact hebben op fundamenteel eiwitonderzoek en medische diagnostiek."
Als kralen door de afvoer
De nieuwe techniek onthult kenmerken van zelfs afzonderlijke aminozuren binnen een peptide, maar hoe dan? Henry Brinkerhoff, eerste auteur van het artikel die dit concept ontwikkelde als postdoc in Dekkers lab, legt uit: "Stel je het koord van aminozuren in een peptidemolecuul voor als een ketting met kralen van verschillende grootte. Stel dat je dan de kraan opendraait terwijl je die ketting langzaam door de afvoer beweegt, wat in dit geval de nanopore is. Als een grote kraal de afvoer blokkeert, stroomt er maar een klein straaltje water door; als de kleinere kralen in de ketting precies bij het afvoerputje zitten, kan er meer water doorstromen. Met onze techniek kunnen we de hoeveelheid stromend water (eigenlijk de ionenstroom) heel precies meten." Cees Dekker vult enthousiast aan: "Een gave eigenschap van onze techniek is dat we een enkele peptidestring steeds opnieuw konden aflezen: we middelen dan alle data voor dat ene molecuul, en kunnen zo het molecuul met 100% nauwkeurigheid identificeren."
Dit resulteert in een unieke uitslag die kenmerkend is voor een specifiek eiwit. Wanneer de onderzoekers ook maar één aminozuur binnen de peptide ("één kraal van de halsketting") veranderden, kregen ze heel verschillende signalen, wat de extreme gevoeligheid van de techniek aangeeft. De groep onder leiding van Alek Aksimentiev aan de Universiteit van Illinois voerde moleculaire dynamica simulaties uit die uitwezen hoe de ionenstroomsignalen zich verhouden tot de aminozuren in de nanopore.
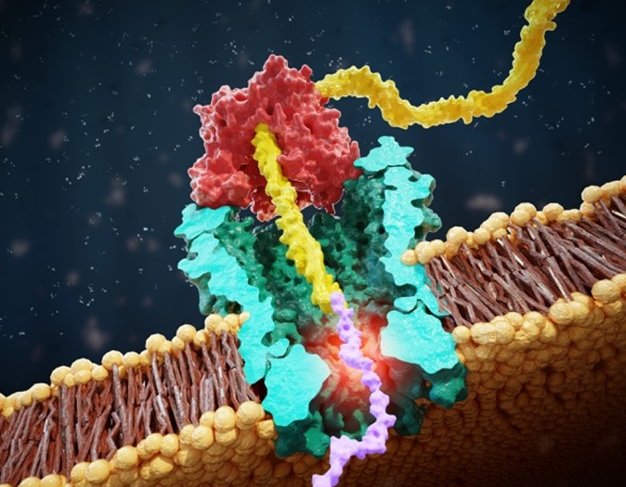
Scannen van de streepjescode voor identificatie
De nieuwe techniek is zeer krachtig voor het identificeren van afzonderlijke eiwitten en het in kaart brengen van minieme onderlinge veranderingen - vergelijkbaar met de manier waarop een kassière in de supermarkt elk product identificeert door de streepjescode te scannen. Het zou ook een nieuwe route kunnen zijn naar het volledig sequencen van eiwitten in de toekomst. Henry Brinkerhoff verduidelijkt: "Onze aanpak kan een basis leggen voor een single-protein sequencer in de toekomst, maar de novo sequencing blijft een grote uitdaging. Daarvoor moeten we eerst nog de signalen van een enorm aantal peptiden karakteriseren om een 'kaart' te maken die de ionenstroomsignalen verbindt met de eiwitvolgorde. Toch is de mogelijkheid om veranderingen van afzonderlijke aminozuren in afzonderlijke moleculen te onderscheiden een enorme vooruitgang, en er zijn meteen al veel toepassingen voor de technologie zoals die er nu is."
Een glimp opvangen van de 'donkere materie' van de biologie
Met deze nanopore peptidenlezer kunnen onderzoekers gaan analyseren welke eiwitten er in onze cellen rondzweven. Na de synthese in de cellen ondergaan eiwitten nog veranderingen die hun functie beïnvloeden, de zogenaamde post-translationele modificaties. De miljoenen eiwitvarianten die daardoor ontstaan, zijn moeilijk te meten en zou je kunnen benoemen als de 'donkere materie van de biologie'. Cees Dekker: "Om de metafoor door te trekken: nadat een ketting met kralen is gemaakt, wordt hij nog bijgewerkt: sommige rode kralen krijgen er een fosfaatgroep bij, sommige blauwe kralen een suikergroep, enzovoort. Deze veranderingen zijn cruciaal voor de werking van eiwitten, en ook een marker voor ziekten zoals kanker. Wij denken dat onze nieuwe aanpak ons in staat zal stellen dergelijke veranderingen te meten op enkel eiwitniveau, en zo een licht te werpen op de eiwitten die wij met ons meedragen."
Meer informatie
H. Brinkerhoff, A.S.W. Kang, J. Liu, A. Aksimentiev, C. Dekker Multiple re-reads of single proteins at single-amino-acid resolution using nanopores. Science, online, 4 November 2021, www.science.org/doi/10.1126/science.abl4381
Artikel